Contenido
¿Qué son los oncogenes?
Un oncogén es un gen celular cuya expresión probablemente promueva el desarrollo de cáncer. ¿Cuáles son los diferentes tipos de oncogenes? ¿Por qué mecanismos se activan? Explicaciones.
¿Qué es un oncogén?
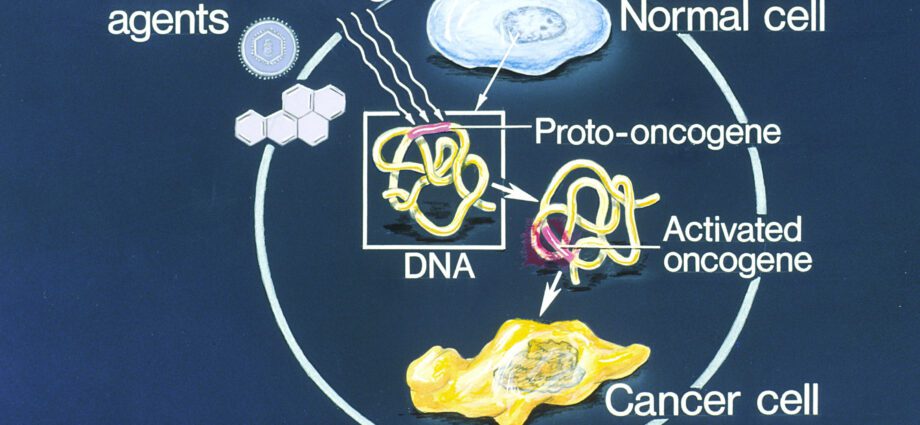
Un oncogén (del griego onkos, tumor y genos, nacimiento) también llamado protooncogén (c-onc) es un gen cuya expresión probablemente confiera un fenotipo canceroso a una célula eucariota normal. De hecho, los oncogenes controlan la síntesis de proteínas que estimulan la división celular (llamadas oncoproteínas) o inhiben la muerte celular programada (o apoptosis). Los oncogenes son responsables de la proliferación celular descontrolada que predispone al desarrollo de células cancerosas.
Los oncogenes se dividen en 6 clases que corresponden respectivamente a las oncoproteínas que codifican:
- factores de crecimiento. Ejemplo: el protooncogén que codifica proteínas de la familia FGF (factor de crecimiento de fibroblastos);
- Receptores del factor de crecimiento transmembrana. Ejemplo: el protooncogén erb B que codifica el receptor EGF (factor de crecimiento epidérmico);
- Proteínas G o proteínas de membrana que se unen a GTP. Ejemplo: protooncogenes de la familia ras;
- proteína quinasas de tirosina de membrana;
- proteína quinasas de membrana;
- proteínas con actividad nuclear.Ejemplo: proto-oncogenes escudo de armas A, fos, Junio et c-myc.
¿Cuál es el papel de los oncogenes?
La renovación celular está asegurada por el ciclo celular. Este último se define por un conjunto de eventos que generan dos células hijas a partir de una célula madre. Estamos hablando de división celular o "mitosis".
El ciclo celular debe estar regulado. De hecho, si la división celular no es suficiente, el organismo no funciona de manera óptima; Por el contrario, si la división celular es abundante, las células proliferan sin control, lo que favorece la aparición de células cancerosas.
La regulación del ciclo celular está garantizada por genes clasificados en dos categorías:
- anti-oncogenes que inhiben la proliferación celular ralentizando el ciclo celular;
- proto-oncogenes (c-onc) u oncogenes que promueven la proliferación celular activando el ciclo celular.
Si comparamos el ciclo celular con un automóvil, los anti-oncogenes serían los frenos y los proto-oncogenes serían los aceleradores de este último.
Anomalías, patologías ligadas a oncogenes
La apariencia de un tumor puede resultar de una mutación que inactiva anti-oncogenes o por el contrario de una mutación que activa proto-oncogenes (u oncogenes).
Una pérdida de función de los anti-oncogenes les impide llevar a cabo su actividad inhibidora de la proliferación celular. La inhibición de los anti-oncogenes es la puerta abierta a la división celular descontrolada que puede conducir a la aparición de células malignas.
Sin embargo, los anti-oncogenes son genes celulares, es decir, están presentes por duplicado en el par de cromosomas que los portan en el núcleo de la célula. Así, cuando una copia del anti-oncogén no es funcional, la otra permite actuar como freno para que el sujeto esté protegido frente a la proliferación celular y frente al riesgo de tumores. Este es el caso, por ejemplo, del gen BRCA1, cuya mutación inhibidora expone el cáncer de mama. Pero si la segunda copia de este gen es funcional, el paciente permanece protegido aunque está predispuesto por la primera copia defectuosa. Como parte de tal predisposición, a veces se considera la mastectomía doble preventiva.
Por el contrario, la mutación activadora que afecta a los protooncogenes acentúa su efecto estimulante sobre la proliferación celular. Esta proliferación celular anárquica predispone al desarrollo de cánceres.
Al igual que los anti-oncogenes, los pro-oncogenes son genes celulares, presentes por duplicado en el par de cromosomas que los portan. Sin embargo, a diferencia de los anti-oncongenos, la presencia de un solo pro-oncogén mutado es suficiente para producir los efectos temidos (en este caso, la proliferación celular). Por tanto, el paciente portador de esta mutación tiene riesgo de cáncer.
Las mutaciones en los oncogenes pueden ser espontáneas, hereditarias o incluso provocadas por mutágenos (químicos, rayos ultravioleta, etc.).
Activación de oncogenes: los mecanismos implicados
Varios mecanismos están en el origen de las mutaciones activadoras de oncogenes o pro-oncogenes (c-onc):
- integración viral: inserción del virus ADN a nivel de un gen regulador. Este es, por ejemplo, el caso del virus del papiloma humano (VPH), que se transmite sexualmente;
- mutación puntual en una secuencia de un gen que codifica una proteína;
- deleción: pérdida de un fragmento de ADN más grande o más pequeño, que constituye una causa de mutación genética;
- reordenamiento estructural: alteración cromosómica (translocación, inversión) que conduce a la formación de un gen híbrido que codifica una proteína no funcional;
- amplificación: multiplicación anormal del número de copias del gen en la célula. Esta amplificación generalmente conduce a un aumento en el nivel de expresión de un gen;
- la desregulación de la expresión de un ARN: los genes se desconectan de su entorno molecular normal y se colocan bajo el control inadecuado de otras secuencias provocando una modificación de su expresión.
Ejemplos de oncogenes
Genes que codifican factores de crecimiento o sus receptores:
- PDGF: codifica el factor de crecimiento plaquetario asociado con el glioma (un cáncer del cerebro);Erb-B: codifica el receptor del factor de crecimiento epidérmico. Asociado con glioblastoma (un cáncer del cerebro) y cáncer de mama;
- Erb-B2 también llamado HER-2 o neu: codifica un receptor de factor de crecimiento. Asociado con cáncer de mama, glándulas salivales y ovario;
- RET: codifica un receptor de factor de crecimiento. Asociado con cáncer de tiroides.
Genes que codifican relés citoplasmáticos en las vías de estimulación:
- Ki-ras: asociado con cáncer de pulmón, ovario, colon y páncreas;
- N-ras: asociado con leucemia.
Genes que codifican factores de transcripción que activan genes promotores del crecimiento:
- C-myc: asociado a leucemia y cáncer de mama, estómago y pulmón;
- N-myc: asociado con neuroblastoma (un cáncer de las células nerviosas) y glioblastoma;
- L-myc: asociado al cáncer de pulmón.
Genes que codifican otras moléculas:
- Hcl-2: codifica una proteína que normalmente bloquea el suicidio celular. Asociado a linfomas de linfocitos B;
- Bel-1: también llamado PRAD1. Codifica Cyclin DXNUMX, un activador del reloj del ciclo celular. Asociado con cáncer de mama, cabeza y cuello;
- MDM2: codifica un antagonista de la proteína producida por el gen supresor de tumores.
- P53: asociado con sarcomas (cánceres de tejido conectivo) y otros cánceres.
Centrarse en los virus ocongénicos
Los virus oncogénicos son virus que tienen la capacidad de hacer cancerosa la célula que infectan. El 15% de los cánceres tienen una etiología viral y estos cánceres virales son la causa de aproximadamente 1.5 millones de nuevos casos por año y 900 muertes por año en todo el mundo.
Los cánceres virales asociados son un problema de salud pública:
- el virus del papiloma está asociado con casi el 90% de los cánceres de cuello uterino;
- El 75% de todos los hepatocarcinomas están relacionados con el virus de la hepatitis B y C.
Hay cinco categorías de virus oncogénicos, ya sean virus de ARN o virus de ADN.
Virus de ARN
- Retroviridae (HTVL-1) lo pone en riesgo de leucemia T;
- Flaviviridae (virus de la hepatitis C) tiene riesgo de carcinoma hepatocelular.
Virus de ADN
- Papovaviridae (papilomavirus 16 y 18) expone al cáncer de cuello uterino;
- Herpesviridae (virus Esptein Barr) expone al linfoma B y al carcinoma;
- Herpesviridae (herpesvirus humano 8) expone a la enfermedad de Kaposi y linfomas;
- Hepadnaviridae (virus de la hepatitis B) es susceptible al carcinoma hepatocelular.